Die Nachahmung physiologischer Bedingungen hilft Forschern bei der Suche nach Metallbindern
Forscher haben eine Methode zur Identifizierung kleiner Moleküle entwickelt, die Metallionen binden. Metallionen sind in der Biologie essentiell. Es kann jedoch eine Herausforderung sein, herauszufinden, mit welchen Molekülen – und insbesondere mit welchen kleinen Molekülen – diese Metallionen interagieren.
Um Metaboliten für die Analyse zu trennen, verwenden herkömmliche Metabolomics-Methoden organische Lösungsmittel und niedrige pH-Werte, die zur Dissoziation von Metallkomplexen führen können. Pieter C. Dorrestein von der University of California San Diego und seine Mitarbeiter wollten die Komplexe für die Analyse zusammenhalten, indem sie die natürlichen Bedingungen in Zellen nachahmten. Wenn sie jedoch bei der Trennung von Molekülen physiologische Bedingungen verwendet hätten, hätten sie die Trennungsbedingungen für jeden physiologischen Zustand, den sie testen wollten, neu optimieren müssen.
Stattdessen entwickelten die Forscher einen zweistufigen Ansatz, der physiologische Bedingungen zwischen einer herkömmlichen chromatographischen Trennung und einer massenspektrometrischen Analyse einführt (Nat. Chem. 2021, DOI: 10.1038/s41557-021-00803-1). Zunächst trennten sie einen biologischen Extrakt mittels konventioneller Hochleistungsflüssigkeitschromatographie. Anschließend stellten sie den pH-Wert des aus der Chromatographiesäule austretenden Flusses so ein, dass er physiologische Bedingungen nachahmte, fügten Metallionen hinzu und analysierten die Mischung mittels Massenspektrometrie. Sie führten die Analyse zweimal durch, um Massenspektren kleiner Moleküle mit und ohne Metalle zu erhalten. Um herauszufinden, welche Moleküle Metalle binden, verwendeten sie eine Berechnungsmethode, die anhand von Peakformen auf Zusammenhänge zwischen den Spektren gebundener und ungebundener Versionen schließt.
Eine Möglichkeit, physiologische Bedingungen weiter nachzuahmen, wäre laut Dorrestein die Zugabe hoher Konzentrationen von Ionen wie Natrium oder Kalium und niedriger Konzentrationen des interessierenden Metalls. „Es wird zu einem Wettbewerbsexperiment. Es wird Ihnen im Grunde sagen, dass dieses Molekül unter diesen Bedingungen eher dazu neigt, Natrium und Kalium oder dieses eine einzigartige Metall, das Sie hinzugefügt haben, zu binden“, sagt Dorrestein. „Wir können viele verschiedene Metalle gleichzeitig infundieren und wir können die Präferenz und Selektivität in diesem Zusammenhang wirklich verstehen.“
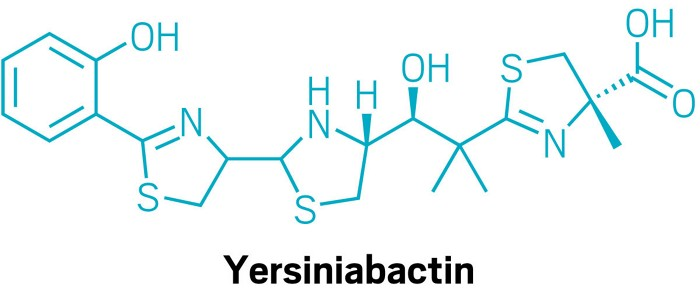
In Kulturextrakten von Escherichia coli identifizierten die Forscher bekannte eisenbindende Verbindungen wie Yersiniabactin und Aerobactin. Im Fall von Yersiniabactin entdeckten sie, dass es auch Zink binden kann.
Die Forscher identifizierten metallbindende Verbindungen in Proben, die so komplex sind wie gelöste organische Stoffe aus dem Ozean. „Das ist absolut eines der komplexesten Beispiele, die ich je gesehen habe“, sagt Dorrestein. „Es ist wahrscheinlich genauso komplex wie Rohöl, wenn nicht sogar komplexer.“ Die Methode identifizierte Domonsäure als kupferbindendes Molekül und legte nahe, dass es Cu2+ als Dimer bindet.
„Ein Omics-Ansatz zur Identifizierung aller metallbindenden Metaboliten in einer Probe ist aufgrund der Bedeutung der biologischen Metallchelatbildung äußerst nützlich“, schreibt Oliver Baars, der an der North Carolina State University metallbindende Metaboliten untersucht, die von Pflanzen und Mikroben produziert werden, in einem E-Mail.
„Dorrestein und Mitarbeiter bieten einen eleganten, dringend benötigten Assay, um die physiologische Rolle von Metallionen in der Zelle besser zu untersuchen“, schreibt Albert JR Heck, ein Pionier der nativen Massenspektrometrieanalysen an der Universität Utrecht, in einer E-Mail. „Ein möglicher nächster Schritt wäre, die Metaboliten unter nativen Bedingungen aus der Zelle zu extrahieren und diese ebenfalls unter nativen Bedingungen zu fraktionieren, um zu sehen, welche Metaboliten welche endogenen zellulären Metallionen tragen.“
Nachrichten aus Chemie und Technik
ISSN 0009-2347
Urheberrecht © 2021 American Chemical Society
Zeitpunkt der Veröffentlichung: 23. Dezember 2021

